(2011?南京模拟)工业上用铝土矿(主要成分是Al
2O
3,还有少量的Fe
2O
3、SiO
2)提取冶炼铝的原料氧化铝.工艺流程如下图:
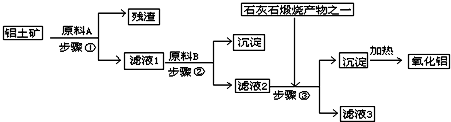
(1)原料A的名称是
盐酸
盐酸
,步骤①反应的离子方程式是
Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
.
(2)滤液1中要加入稍过量原料B,原料B的化学式是
NaOH
NaOH
,步骤②反应的离子方程式是:
H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O
H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O
.
(3)步骤③的化学方程式是:
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质
.

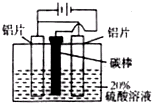 (2013?德州一模)I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫 酸,模拟该生产过程如下:
(2013?德州一模)I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫 酸,模拟该生产过程如下:
