氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.在氮气流中由氧化铝与焦炭在电炉中加热制得.原料配比不当或反应不完全等因素都会造成产品中含有碳、Al
4C
3或Al
2O
3等杂质.回答下列问题:
(1)反应Al
2O
3+N
2+3C
2AlN+3CO中,氧化剂是
(2)探究氮化铝与酸的反应,并检验生成产物中含有NH
4+.请完成下列实验步骤.
步骤1:取少量样品于试管中,滴加稀H
2SO
4至溶液呈酸性
步骤2:
.
(3)AlN也可以与强碱溶液反应.完成下列方程式:
AlN+NaOH+H
2O=
+
(4)Al
4C
3与水反应生成甲烷,甲烷与CuO反应的化学方程式如下:
CH
4+4CuO
CO
2+2H
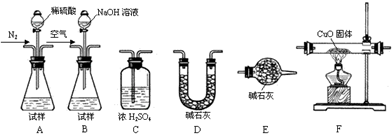
2O+4Cu 测定产品中有关成分的含量,所需仪器如下:
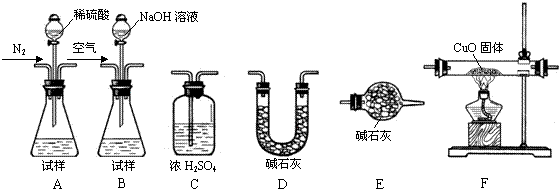
Ⅰ.测定样品中含有少量Al
4C
3的含量,各装置连接的顺序为A→C→F→C→D→E.主要实验步骤如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N
2⑤再次缓缓鼓入一定量的N
2⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→
→⑤→⑥→⑦,操作④的目的是
.
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
→
→
→E,试样为mg,测得C增重n g,则AlN的质量分数是
.

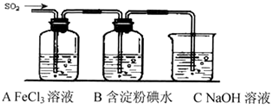
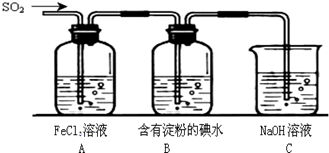
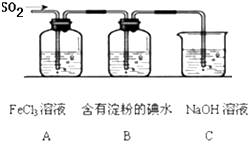 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: