
题目列表(包括答案和解析)
有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。根据下表信息,回答有关问题:
| 溶质的质量分数 | 溶液的密度(g?cm-3) |
第一份溶液 | ω1 | ρ1 |
第二份溶液 | ω2 | ρ2 |
⑴第一份溶液中,溶质的物质的量浓度为 。
⑵取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
⑶若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小?① ② 。
有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol.根据下表信息,回答有关问题:

(1)第一份溶液中,溶质的物质的量浓度为________.
(2)取等质量的两份溶液混合,所得混合液中溶质的质量分数w3=________.
(3)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,试比较w3、w4的相对大小:________.
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________________________________________________。
(2)实验室保存。FeCl2溶液时通常会向其中加入少量试剂______________和_____________。
(3)实验2中通人足量Cl2的目的是__________________________________________________。
涉及的化学反应的离子方程式是___________________________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法_______________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)___________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是___________(填写序号字母)。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能做布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为____________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
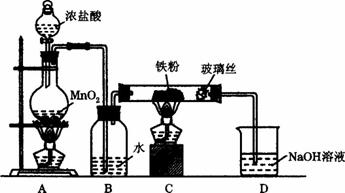
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_____________________________________________________________________。
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
| ⑩ | ⑧ | ⑨ | |||||||||||||||
 .
.
实验时可供选择的试剂有:①未知浓度的NaOH溶液;②37%盐酸;③40%硫酸;④14%盐酸;⑤大理石;⑥K2CO3固体.
实验室现有如下仪器:铁架台、启普发生器、量筒、烧杯、乳胶管、玻璃导管、玻璃棒、分液漏斗.
下表所列为有关物质在常温时溶解度(g/100 g水):
|
Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
|
15.9 |
8.40 |
35.8 |
35.5 |
20.0 |
40.0 |
(1)本实验应选用的仪器,除启普发生器、乳胶管、玻璃导管外,还应有______________.
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品除①外,还应需要_____________.
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装不必叙述).
①量取两份相同体积的NaOH溶液;②_______________________________;③______
_______________________________.
(4)根据给出的溶解度数据,若保证在配制过程中不析出晶体,所用NaOH溶液中含有NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com