
题目列表(包括答案和解析)
| |||||||||||||||
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
 根据硫化氢气体的实验室制法和性质完成下列填空。
根据硫化氢气体的实验室制法和性质完成下列填空。

【小题1】 若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。 a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁 c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
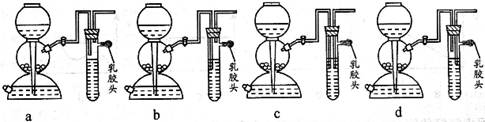
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁 【小题2】现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;
【小题2】现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器; ______________(填编号)。
______________(填编号)。




 【小题3】如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
【小题3】如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液, 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到 的现象是___________________________________________________。
的现象是___________________________________________________。 【小题4】在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
【小题4】在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为: ______________________________________________________________
______________________________________________________________ 反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。 【小题5】点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
【小题5】点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
 【小题6】已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
【小题6】已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
Ⅰ.(4分)实验室有一瓶澄清的溶液,实验人员确定其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行下列实验:
①取pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
⑥向②的水层中加入HNO3酸化的AgNO3溶液有白色沉淀。
根据上述实验事实确定,请你判断该溶液中
(1)肯定存在的离子是 ;
(2)不能确定是否存在的离子是 。
Ⅱ. (6分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+ 4KI+ 4HNO3→Se+2I2+ 4KNO3+2H2O ②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。
Ⅰ.(4分)实验室有一瓶澄清的溶液,实验人员确定其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行下列实验:
①取pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
⑥向②的水层中加入HNO3酸化的AgNO3溶液有白色沉淀。
根据上述实验事实确定,请你判断该溶液中
(1)肯定存在的离子是 ;
(2)不能确定是否存在的离子是 。
Ⅱ. (6分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+ 4KI+ 4HNO3→Se+2I2+ 4KNO3+2H2O ②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com