
题目列表(包括答案和解析)
物质的加热是中学化学实验的基本操作之一,常用的加热方式有三种:Ⅰ.直接用酒精灯加热;Ⅱ.通过石棉网用酒精灯加热;Ⅲ.通过水浴加热.下列实验中:
①电石与水反应制乙炔;
②氯化铵与碱石灰反应制取氨气;
③苯和液溴反应制取溴苯;
④苯酚和甲醛反应制取酚醛树脂;
⑤葡萄糖与银氨溶液发生银镜反应;
⑥浓盐酸与二氧化锰反应制取氯气;
⑦乙酸和乙醇反应制取乙酸乙酯;
⑧硝酸、硫酸和苯反应制取硝基苯.
请将上述实验的序号填入下列空格中:
(1)需要用酒精灯直接加热的是________;
(2)需要垫上石棉网再用酒精灯加热的是________;
(3)需要通过水浴加热的是________.
| ||
| ||
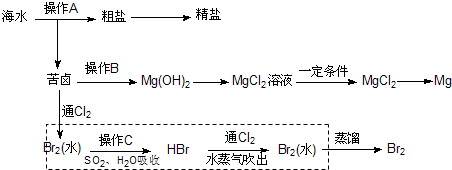
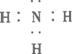
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是(写一种):__________
__________;检验气体H已收集满的方法是:__________。
(2)在实验室进行操作①时,除了使用酒精灯、铁圈、铁架台及夹持仪器外,还缺少的仪器是:____________;在进行操作②时,应在HCl的气氛中加热脱水,其目的是:__________。
(3)A+H2O![]() B+H的基本反应类型为__________,H的电子式为__________。
B+H的基本反应类型为__________,H的电子式为__________。
(4)如下图所示支管中,左管中放入MnO4固体,右管中放入小块钠,再向两管均加入适量8 mol·L-1的盐酸,半分钟后,盖上橡胶塞并将此支管固定在铁架台上。用一照相机对准此支管,按快门,闪光灯闪亮。请回答:
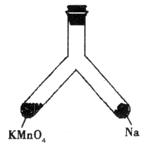
①“照相”之前,左管中反应生成的气体是__________(写化学式),若生成0.5 mol该气体,则转移电子的物质的量是__________mol。
②“照相”时,灯光闪亮,支管随之出现的现象是__________。
| ||
| ||
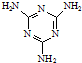
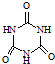
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com