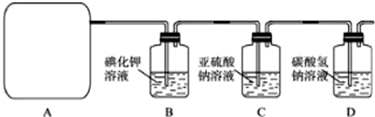
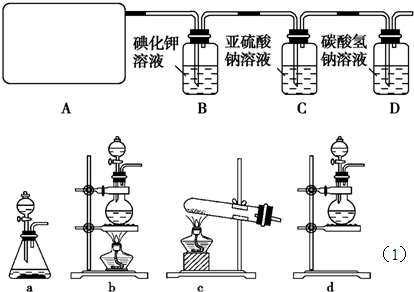
某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)
2+CaCl
2+2H
2SO
42CaSO
4+2Cl
2↑+2H
2O他们设计了如图所示装置制取氯气并验证其性质的实验.
试回答:
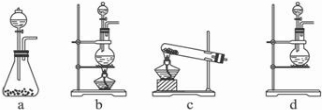
(1)该实验中A部分的装置是
b
b
(填写装置的序号);
(2)B中反应的化学方程式是
Cl2+2KI=2KCl+I2
Cl2+2KI=2KCl+I2
;
(3)写出C中反应的离子方程式
Cl2+SO32-+H2O=SO42-+2Cl-+2H+;
Cl2+SO32-+H2O=SO42-+2Cl-+2H+;
,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na
2SO
3已被氧化(简述实验步骤):
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
;
(4)写出在D装置中发生反应的离子方程式
Cl2+H2O?H++Cl-+HClO,HCO3-+H+=H2O+CO2↑(或者Cl2+HCO3-=CO2↑+Cl-+HClO)
Cl2+H2O?H++Cl-+HClO,HCO3-+H+=H2O+CO2↑(或者Cl2+HCO3-=CO2↑+Cl-+HClO)
;
(5)该实验存在明显的缺陷是
无尾气处理装置
无尾气处理装置
;
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,加入过量的KI溶液和过量的H
2SO
4溶液,静置.待完全反应后,用0.1mol?L
-1的Na
2S
2O
3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI,反应完成时,共消耗Na
2S
2O
3 200mL.则该漂白粉中Ca(ClO)
2的质量分数为
35.8%(或35.75%).
35.8%(或35.75%).
.