
题目列表(包括答案和解析)
(12分) A、B、C、D、E、F六种化合物。其中A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,B、C、E均由三种元素组成,B、C的组成元素相同,且C的摩尔质量比B大80g/mol请回答下列问题:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含有B的溶液中,加入稀H2S04,产生浅黄色浑浊和无色有刺激性气味的气体。 |
| ② | 20 ml沸水中滴加F的饱和溶液1~2ml,所得液体呈红褐色 |
| ③ | 将实验②得到的红褐色液体加热蒸发、灼烧,最终得到红棕色固体 |
 若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 ,E·XH20的化学式为 。
若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 ,E·XH20的化学式为 。(12分) A、B、C、D、E、F六种化合物。其中A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,B、C、E均由三种元素组成,B、C的组成元素相同,且C的摩尔质量比B大80g/mol请回答下列问题:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
|
序号 |
主要实验步骤及实验现象 |
|
① |
在含有B的溶液中,加入稀H2S04,产生浅黄色浑浊和无色有刺激性气味的气体。 |
|
② |
20 ml沸水中滴加F的饱和溶液1~2ml,所得液体呈红褐色 |
|
③ |
将实验②得到的红褐色液体加热蒸发、灼烧,最终得到红棕色固体 |
写出B与稀H2S04反应的离子方程式: ;
写出②中反应的化学方程式: 。
(3)现由6种粒子Mn2+、MnO4一、H十、H2 0、X2Y82一(C中含有的阴离子)、XY42一完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4一需氧化剂的物质的量为 。
(4)化合物D和E可以相互转化: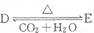 若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
,E·XH20的化学式为
。
若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
,E·XH20的化学式为
。
(1)写出:A的化学式__________ ,F的化学式____________ 。
(2)在反应①~⑦中,不属于氧化还原反应的是 ___________(填序号)。
(3)完成:E和X反应的离子方程式:________________ ;
(4)完成H和某种化合物快速制C的化学方程式_________ ,每生成0.15molC电子转移 _________mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:___________ 。
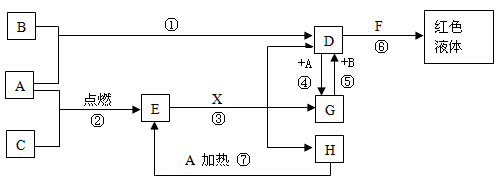
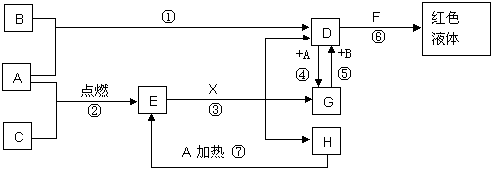
A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为气体,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
 |
(1)写出:A的化学式 ,F的化学式 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填序号)。
(3)完成:E和X反应的离子方程式: ;
(4)完成H和某种化合物快速制C的化学方程式 ,每生成0.15molC电子转移 mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
。
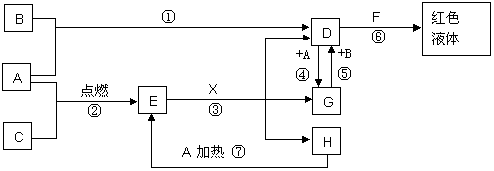
A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为气体,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
 |
(1)写出:A的化学式 ,F的化学式 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填序号)。
(3)完成:E和X反应的离子方程式: ;
(4)完成H和某种化合物快速制C的化学方程式 ,每生成0.15molC电子转移 mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com