(2011?兖州市三模)I.A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图1所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置
第四周期、第Ⅷ族
第四周期、第Ⅷ族
,
(2)写出反应④的离子方程式
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
.
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH
<
<
7(填“>”、“<”或“=”),用离子方程式表示其原因:
NH
4++H
2O

NH
3?H
2O+H
+NH
4++H
2O

NH
3?H
2O+H
+.
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)
3沉淀.Fe(OH)
3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①
Fe-2e-=Fe2+
Fe-2e-=Fe2+
; ②4OH
--4e
-=2H
2O+O
2↑.
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH
4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH
4+4
-8e
-=5CO
2+2H
2O
①正极的电极反应是
O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是
CO2
CO2
.
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH
4(标准状况)
11.2
11.2
L.


 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+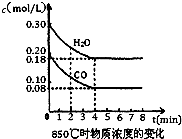 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4. (2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.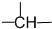 、z个
、z个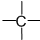 ,则-CH3最多有(用含x、y、z的代数式表示)
,则-CH3最多有(用含x、y、z的代数式表示) (2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.
(2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.