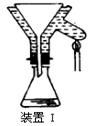
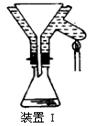
(2012?东城区一模)某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H
2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.

(1)写出甲装置中电解饱和食盐水的化学方程式
2NaCl+2H
2O
2NaOH+H
2↑+Cl
2↑
2NaCl+2H
2O
2NaOH+H
2↑+Cl
2↑
.
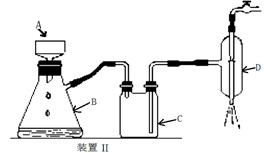
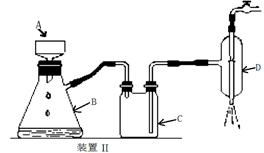
(2)为完成上述实验,正确的连接顺序为A连
E
E
;B连
C
C
(填写导管口字母).
(3)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为
先通一段时间氢气并在D处检验氢气的纯度
先通一段时间氢气并在D处检验氢气的纯度
.
(4)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是
淀粉KI溶液
淀粉KI溶液
,对应的现象为
溶液变为蓝色
溶液变为蓝色
.乙装置烧杯中发生反应的离子方程式是
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(5)丙装置的c瓶中盛放的试剂为
浓硫酸
浓硫酸
,作用是
吸收H2中的H2O,防止硬质玻璃管炸裂,或影响测定水的质量
吸收H2中的H2O,防止硬质玻璃管炸裂,或影响测定水的质量
.
(6)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:精确测量硬质玻璃管的质量为ag,放入CuO后,精确测量硬质玻璃管和CuO的总质量为bg(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量.
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量.
①请你分析并回答:
甲
甲
方案所测结果更准确.你认为不合理的方案的不足之处是
空气中的CO2和H2O通过D口进入U形管造成实验误差较大
空气中的CO2和H2O通过D口进入U形管造成实验误差较大
.
②若按合理方案测定的数据计算,Cu的相对原子质量为
.










 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用