
题目列表(包括答案和解析)
C.0.04 mol·L D.0.08 mol·L-1
已知H2+I2 2HI △H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI △H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 |
| B.甲中加入0.1 molHe,乙不改变 |
| C.甲降低温度,乙不变 |
| D.甲增加0.1 molH2,乙增加0.1 mol I2 |
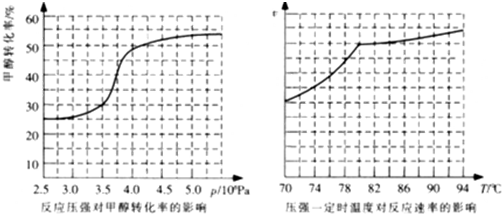
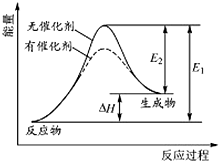 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.| 催化剂 | △ |
| A、CO燃烧的热化学方程式为:2CO(g)+O2(g)═2CO2(g)△H=+282.8 kJ/mol | B、H2燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | C、燃烧前混合气体中,H2的体积分数为40% | D、燃烧后的混合气体与足量的过氧化钠反应,转移电子的物质的量为2 mol |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com