
题目列表(包括答案和解析)
某元素的3p轨道上有两个未成对电子,则下列说法正确的是( )
A.第三电子层上有4个电子 B.最高正价为+2
C.最高正价为+4 D.第二电子层没有未成对电子
【解析】根据构造原理可知,若3p轨道上有两个未成对电子,则该元素的原子序数为14或16,所以正确的答案是D。
某元素的3p轨道上有两个未成对电子,则下列说法正确的是( )
A.第三电子层上有4个电子 B.最高正价为+2
C.最高正价为+4 D.第二电子层没有未成对电子
【解析】根据构造原理可知,若3p轨道上有两个未成对电子,则该元素的原子序数为14或16,所以正确的答案是D。
最近,科学家用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相类似。该化学反应是:
A.H2O+CH3COOH 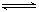 H3O++CH3COO-
H3O++CH3COO-
B.Zn+2HCl = ZnCl2+H2↑
C.CO2+2NH3 = CO(NH2)2+H2O
D.NH3+HCl = NH4Cl
【解析】根据反应的特点可以判断类似于氯化铵的生成,因为氨气获得1个质子生成NH4+,NH4+和氯离子结合生成氯化铵,所以答案是D。
下列关于元素周期表和元素周期律的说法,正确的是
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着相对原子质量的增加而呈周期性的变化
C.同一主族的元素从上到下,金属性呈周期性变化
D.俄国化学家门捷列夫为元素周期表的建立做出了巨大贡献
【解析】根据元素周期律可判断,新的元素是可以发现的,A错误。元素周期律的实质是元素原子核外电子排布周期性变化的必然结果,与相对原子质量无关,B不正确。同主族元素自上而下,金属性逐渐减弱,而不是呈周期性的变化,C不正确。答案选D。
下列关于元素周期表和元素周期律的说法,正确的是
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着相对原子质量的增加而呈周期性的变化
C.同一主族的元素从上到下,金属性呈周期性变化
D.俄国化学家门捷列夫为元素周期表的建立做出了巨大贡献
【解析】根据元素周期律可判断,新的元素是可以发现的,A错误。元素周期律的实质是元素原子核外电子排布周期性变化的必然结果,与相对原子质量无关,B不正确。同主族元素自上而下,金属性逐渐减弱,而不是呈周期性的变化,C不正确。答案选D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com