
题目列表(包括答案和解析)
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质] (2013?德州一模)【化学一物质结构与性质】
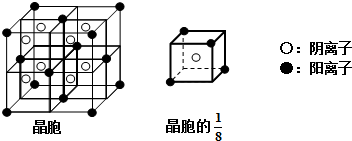
(2013?德州一模)【化学一物质结构与性质】 [化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
[化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.| … | A | |||||
| B | C | D |
| 234 |
| NAa3 |
| 234 |
| NAa3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com