
题目列表(包括答案和解析)
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产了纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3=Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特旬原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据 上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
|
第二同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.过氧化钾 H.金刚石
(1)属于原子晶体的化合物是__________,直接由原子构成的晶体是__________,直接由原子构成的分子晶体是__________。
(2)由极性分子构成的晶体是__________,含有共价键的离子晶体是__________,属于分子晶体的单质是__________。
(3)受热熔化后化学键不发生变化的是__________,需克服共价键的是__________。
(1)属于原子晶体的化合物是__________,直接由原子构成的晶体是__________,直接由原子构成的分子晶体是__________。
(2)由极性分子构成的晶体是__________,含有共价键的离子晶体是__________,属于分子晶体的单质是__________。
(3)受热熔化后化学键不发生变化的是__________,需克服共价键的是__________。
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答下列问题:
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是 (填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有 (填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:

①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 。
②若在乙中收集氨气,气体流经装置的顺序是:a



 d(填接口代号)。
d(填接口代号)。
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。

(1)装置B中试剂的作用是 。
(2)认为气体Y中还含有CO2的理由是 (用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.. A之前 b . A-B间 c . B-C间 d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是 。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: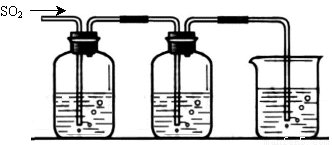
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(5)装置C的作用是 。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(7)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 (8)能表明I-的还原性弱于SO2的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com