
题目列表(包括答案和解析)
下列关于阿伏加德罗常数NA的说法正确的是( )
A.在铜与硫的反应中,1mol铜失去的电子数为2NA。
B.Cu与足量浓HNO3反应转移NA电子生成的气体在标况下占22.4L(忽略气体溶解及逸散)。
C.31g白磷中含有P—P键的个数为4NA
D.足量Fe与一定量热的浓H2SO4反应放出l mol气体时转移的电子数为2NA(忽略气体溶解及逸散)。
【解析】硫的氧化性比较弱,和铜反应生成的是Cu2S,因此1mol铜失去的电子数为NA。铜和浓硝酸反应的方程式为3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO2↑,即每生成2molNO2转移电子是6mol,因此选项B是错误的。白磷是正四面体结构,1个白磷分子中含有6个P-P键,31g白磷是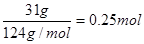 ,所以含有的P—P键为0.25mol×6=1.5mol,D不正确。因为铁是过量的,所以生成物是硫酸亚铁,即铁和浓硫酸反应的方程式为Fe+2H2SO4(浓)
,所以含有的P—P键为0.25mol×6=1.5mol,D不正确。因为铁是过量的,所以生成物是硫酸亚铁,即铁和浓硫酸反应的方程式为Fe+2H2SO4(浓)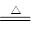 FeSO4+H2O+SO2↑,所以选项D是正确的。答案选D。
FeSO4+H2O+SO2↑,所以选项D是正确的。答案选D。
下列事实不能说明非金属性Cl>I的是( )
A.Cl2+2I-==2Cl-+I2 B.稳定性:HCl>HI
C.酸性 HClO4>HIO4 D.酸性 HClO3>HIO3
【解析】考查非金属性强弱的比较。比较非金属性强弱可以利用最高价氧化物对应水化物的酸性强弱,和氢气化合的难易程度以及相应氢化物的稳定性或者是单质间的相互置换能力等。所以选项D是错误的,答案是D。
下列实验用来证明SO2的存在,其中正确的是( )
A.能使品红褪色。
B.能使湿润的蓝色石蕊试纸变红。
C.通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸。
D.通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。
【解析】具有漂泊性的物质不止二氧化硫一种,A不能证明。酸性气体都可以使湿润的蓝色石蕊试纸变红,B不能证明。选项C中也可以是CO2,所以也不能证明。通入稀溴水中能使溴水褪色,得澄清溶液,说明该气体具有还原性。再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸,则说明沉淀是硫酸钡,所以气体是二氧化硫,因此正确的答案是D。
下列有关晶体的叙述中错误的是
A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子
B.氯化钠晶体中每个Na+周围紧邻的有6个Cl—
C.CsCl晶体中每个Cs+周围紧邻的有8个Cl—,每个Cs+周围等距离紧邻的有6个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
【解析】在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子,所以选项D是错误的,答案选D。
下列实验用来证明SO2的存在,其中正确的是( )
A.能使品红褪色。
B.能使湿润的蓝色石蕊试纸变红。
C.通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸。
D.通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。
【解析】具有漂泊性的物质不止二氧化硫一种,A不能证明。酸性气体都可以使湿润的蓝色石蕊试纸变红,B不能证明。选项C中也可以是CO2,所以也不能证明。通入稀溴水中能使溴水褪色,得澄清溶液,说明该气体具有还原性。再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸,则说明沉淀是硫酸钡,所以气体是二氧化硫,因此正确的答案是D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com