
题目列表(包括答案和解析)
磷酸氢二铵[(NH4)2HPO4]可用作复合肥料。关于该物质的下列说法不正确的是( )
A.HPO42-中含有共价键,其中P的化合价为+5价
B.是一种离子化合物,其中铵根离子的电子式为
C.该化合物中所有原子均满足8电子稳定结构
D.其中P元素的质量分数比N元素的质量分数高
【解析】HPO42-中的元素全部是非金属元素,因此形成的化学键是共价键,H是+1价的,O是-2价的,所以P是+5价的,A正确。铵盐都是离子化合物,B正确。H元素不可能满足8电子稳定结构,C是错误的。P的相对原子质量是31,而2个N原子才是28,所以选项D是正确的。答案选C。
将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为电能
C.NaOH溶液的浓度约是1.5mol/L
D.该实验表明有水生成的反应都是放热反应
【解析】温度为22℃对应的盐酸的体积是5ml,即该温度是反应后溶液的温度,因此环境温度一定低于22℃.只有当二者恰好反应时放出的热量才最多,溶液的温度才最高,根据图像可判断当盐酸的体积是30ml时温度最高,所以氢氧化钠的浓度是![]() ,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是( )
A.氯化铝是电解质 B.固体氯化铝是分子晶体
C.可用电解熔融氯化铝的办法制取金属铝 D.氯化铝为非极性分子
【解析】根据氯化铝的物理性质可知,氯化铝是共价化合物,形成的晶体是分子晶体。苯和乙醚均是非极性分子,根据相似相溶原理知氯化铝也是非极性分子。氯化铝溶于水可以导电,但在熔融状态下不能导电,所以选项C是错误的,答案选C。
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是
A.当溶液中c(CH3COO─)=c(Na+)时,醋酸与氢氧化钠恰好完全反应
B.当溶液中c(CH3COO─)=c(Na+)时,一定是氢氧化钠过量
C.当溶液中c(CH3COO─)=c(Na+)>c(H+)=c(OH─)时,一定是醋酸过量
D.当溶液中c(Na+)>c(CH3COO─)>c(OH─)>c(H+)时,一定是氢氧化钠过量
【解析】若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠水解,溶液显解析,A不正确。根据电荷守恒c(CH3COO─)+c(OH─)=c(Na+)+c(H+)可知,当c(CH3COO─)=c(Na+)时,c(OH─)=c(H+),即溶液显中性,此时醋酸应该是过量的,所以B错误,C是正确的。在选项D中也可能是二者恰好反应,因此D也是错误的。答案选C。
在373K时,密闭容器中冲入一定物质的量的NO2和SO2,发生如下反应:
NO2+SO2
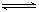 NO+SO3,当反应达平衡时,下列叙述正确的时:
NO+SO3,当反应达平衡时,下列叙述正确的时:
A NO和SO3的物质的量一定相等
B NO2和SO2的物质的量一定相等
C 平衡体系中总物质的量一定等于反应开始时总物质的量
D SO2、NO2、NO、SO3的物质的量一定相等
【解析】在一定条件下,当可逆反应中正反应速率和逆反应速率相等时,各种物质的浓度和含量不再随时间变化而变化,把这种状态称作平衡状态,因此A、B、D不一定正确。因为反应前后气体体积不变,所以平衡体系中总物质的量一定等于反应开始时总物质的量,即选项C是正确的。答案选C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com