
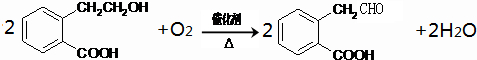
题目列表(包括答案和解析)
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粉) | 0.1mol/L | 125s |
| ② | 10g(锌粉) | 0.2mol/L | 62s |
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粉) | 0.1mol/L | 125s |
| ② | 10g(锌粉) | 0.2mol/L | 62s |



| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粉) | 0.1mol/L | 125s |
| ② | 10g(锌粉) | 0.2mol/L | 62s |
通过考查周期表中各族元素性质的变化趋势,推论下列关于砹(At、原子序数为85)的问题的合理答案.
(1)由KAt水溶液制备砹的化学方程式为_________________________.
(2)若将浓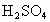 加到固体KAt上,估计发生反应的方程式为_________,产生的现象是______________.
加到固体KAt上,估计发生反应的方程式为_________,产生的现象是______________.
(3)写出一种不溶性砹化物的化学式,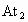 是否溶于
是否溶于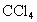 ?
?
_________________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com