
题目列表(包括答案和解析)
|
向稀硫酸中加入铜粉不发生反应,若再加入下列某种盐,则铜粉可以逐渐溶解.符合此条件的盐是 | |
| [ ] | |
A. |
NaN03 |
B. |
KCl |
C. |
ZnS04 |
D. |
FeSO4 |
已知存在如下反应:① A+B![]() C+D ② D
C+D ② D![]() A+E
A+E
③C + E![]() B(以上暗影方程均未配平)
B(以上暗影方程均未配平)
其中A和C为常见金属单质;B和D为氧化物且B具有磁性;E为无色气体单质。
据此回答:
(1)D可溶于强酸和强碱,写出D与氢氧化钠溶液反应的离子方程式 。
(2)物质E是 (填化学式);在反应①中,1mol B发生反应时转移电子的物质的量是 。
(3)将单质A和C用导线连接,与稀硫酸构成原电池,则该原电池的负极是
(填元素符号),正极的电极反应式是 。
(4)B与过量稀硝酸相遇,可生成一种无色气体,写出此反应的离子方程式
;
若将B溶于盐酸中可形成溶液F,F中存在的两种金属阳离子是 (填离子符号)。现有如下三种检验F中的低价金属阳离子的实验方案(包括实验步骤及预设实验现象):
分别取少量P溶液于三支洁净的试管中,
①向第一支试管滴加KSCN溶液,溶液不变色,再滴加氯水,溶液变红色
②向第二支试管中溶液的底部用滴管注入NaOH溶液,生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色
③向第三支试管中滴加酸性KMnO4溶液振荡,KMnO4溶液紫色褪去
上述三种方案中合理的是 (填①、②或③);
若向溶液F中加入少量铜粉,震荡后,铜粉渐溶解,请写此过程中发生反应的离子方程式 。
甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
①用20%的![]() 溶液,通过反应
溶液,通过反应![]() 来制取氧气,则在下列A、B、C三装置中最佳装置是_____
来制取氧气,则在下列A、B、C三装置中最佳装置是_____
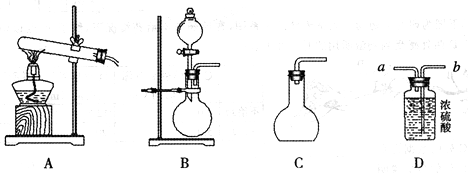
②与气体发生装置相连接的D装置的导管口是_____
③为了能使产生的氧气被充分干燥,可采取的操作是
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知: 铜与氧气的反应有:①![]() ,②
,②![]() ;在酸性条件下:
;在酸性条件下:![]() 。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(
。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(![]() )。
)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有![]() ,甲、乙、丙三同学分别设计如下实验方案。
,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有___ ,则说明固体中含有![]() 。
。
乙同学的实验方案是:再将粉末X放人氧气中加热,如果其质量增加,则说明其中含有![]() 。
。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。若n的取值范围是![]() ,则粉末X中含有
,则粉末X中含有![]() ,其物质的量是_____。
,其物质的量是_____。
请你再设计一个与上述三个实验方案中现象均不相同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有![]() 。写出该实验中反应的离子方程式。
。写出该实验中反应的离子方程式。
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com