
题目列表(包括答案和解析)
(12分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离: H2A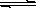 H++HA-, HA-
H++HA-, HA-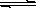 H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
(12分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2AH++HA-, HA-
H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02mol·L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
(12分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA-,
HA-
H++HA-,
HA- H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
(12分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察______ _ 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______________色变成____________色。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________。
( 12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A (g)  B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,C2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
 (3) 如果2A
(g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
(3) 如果2A
(g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com