
题目列表(包括答案和解析)
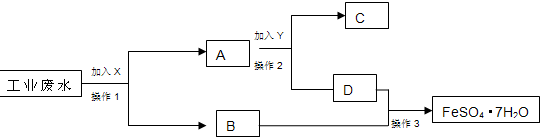
(14分)某工厂的工业废水中含大量的FeSO4、较多的Cu2+,和少量Fe3+。为减少污染并再利用资源,工厂计划从废水中回收硫酸亚铁和金属铜。相关流程图如下
![]()

(1)操作①中加入的试剂是 ,操作方法是 ;
![]() 相关的离子反应方程式是 , ;
相关的离子反应方程式是 , ;
(2)操作②中加入的试剂是 ,固体2是 ;
(3)操作③的实验方法是 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com