
题目列表(包括答案和解析)
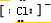
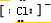
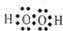
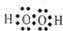
| ||
| ||
(1)其原子半径大小关系是:D>E>B>C>A。
(2)A、D同主族,并可形成离子晶体DA、
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH_________(填“>”“<”或“=”)7。
(2)D
(3)1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生_________mol A2气体,并写出其反应的离子方程式__________________。
(4)写出B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水的离子方程式:
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
(5)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为___________________________。
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极,浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极,浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com