
题目列表(包括答案和解析)
(14分)2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。
则该电池的正极反应____ ___
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。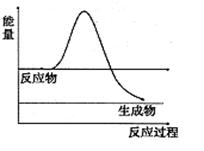
⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |

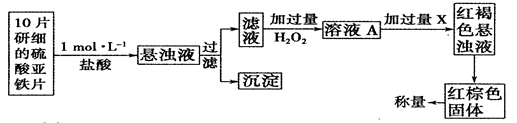


| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |


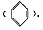 根据现代物理方法如X射线法、光谱法等证明了苯分子是一个平面正六边形构型,且其中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键。由于苯分子结构中的正负电荷重心重合。所以苯是一种非极性分子,易溶解许多非极性的有机物及澳单质和碘单质等,不溶于水,密度为0. 879 g/cm3,沸点为80.5℃。
根据现代物理方法如X射线法、光谱法等证明了苯分子是一个平面正六边形构型,且其中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键。由于苯分子结构中的正负电荷重心重合。所以苯是一种非极性分子,易溶解许多非极性的有机物及澳单质和碘单质等,不溶于水,密度为0. 879 g/cm3,沸点为80.5℃。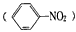 反应温度应控制在50℃~60℃。温度过高会导致苯的挥发及浓硝酸的分解。
反应温度应控制在50℃~60℃。温度过高会导致苯的挥发及浓硝酸的分解。 X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
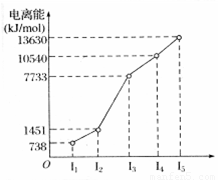
(1)X原子的电子排布式为 。
(2)电负性:X Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。 有关Z2H4分子的说法正确的是 (填字母)。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.Z原子的杂化方式为sp2
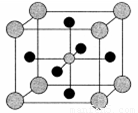
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构如图所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围 (填数字)个氧离子相紧邻。
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.非极性键 C.配位键 D.金属键


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com