
题目列表(包括答案和解析)
有以下几种物质:
| A.熔融状态的硝酸钾 | B.硫酸(H2SO4) | C.醋酸(CH3COOH) | D.BaSO4固体 |
(1)在标准状况下,有下列物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2。其
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:
已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(3)写出实验室制取氯气的化学方程式 。w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
某同学用18 mol/L的浓硫酸配制200mL 0.9mol/L的稀硫酸,并进行有关实验。请回答下列问题:
(1)需要量取浓硫酸 mL。
(2)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是( )w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
| A.可以按此建议改进,便于使用容量瓶 |
| B.不能按此建议改进,因为会降低容量瓶的精确度 |
| C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度改刻在容量瓶的瓶身上 |
| D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
实验室现只有下列几种规格的容量瓶:100mL、200mL、250mL、500mL。某个实验中需要0.50 mol·L-1NaOH溶液450 mL和0.46 mol·L-1硫酸溶液500 mL,根据相关情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)用18.4 mol/L的浓硫酸配制0.46 mol·L-1硫酸溶液500 mL的实验中, 步用到胶头滴管。
(3)根据计算用托盘天平称取NaOH的质量为 g。若NaOH固体溶解后立即转移至容量瓶,则所得溶液浓度 0.50 mol·L-1(填“大于”、“等于”或“小于”,下同)。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.50 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
。高.考.资.源.网
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
A.C(s)+H2O(g)==CO(g)+H2(g):△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O(![]() )+8H2O(
)+8H2O(![]() )△H>0
)△H>0
C.CaC2(s)+2 H2O(![]() )==Ca(OH)2(s)+C2H2(g);△H<0
)==Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)==CO2(g)+2H2O(![]() ):△H<0
):△H<0
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
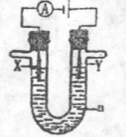 ②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为 mol。高☆考♂资♀源*网
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO?4溶液。
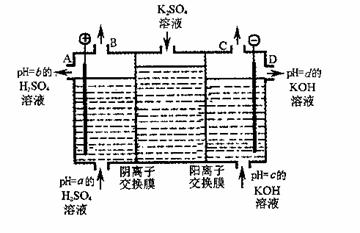 ① 该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
① 该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com