
题目列表(包括答案和解析)
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)Si(s)+4HCl(g) ΔH=+Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应), 下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中 恰好反应
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
| A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率 |
B.已知,一定温度下,反应的平衡常数(k)为定值,若向已经达到平衡状态的容器中再次加入四种物质,若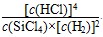 >k,平衡就要向正反应方向移动 >k,平衡就要向正反应方向移动 |
| C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收 |
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
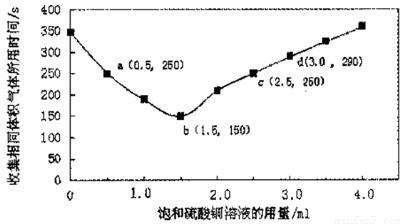
A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a ,c两点对应的氢气生成速率相等
C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1
D.d点没有构成原电池,反应速率减慢
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q
kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q
kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率
B.已知,一定温度下,反应的平衡常数(k)为定值,若向已经达到平衡状态的容器中再次加入四种物质,若 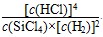 >k,平衡就要向正反应方向移动
>k,平衡就要向正反应方向移动
C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0) ,某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0) ,某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com