
题目列表(包括答案和解析)
某学生根据高中课本中硝酸钾受热分解的实验操作来判断硝酸铅的分解产物之一是氧气;将试管中的硝酸铅加热到熔融,把带有火星的细木条伸进试管口,检验放出的气体,当发现木条复燃时该学生即断言,硝酸铅受热分解有氧气放出。请你对上述实验及结论的合理性作出评价。如有必要,可提出改进的实验方案。
I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:

⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
探究式课堂教学由于注重知识的形成过程而很好地体现了新课改的理念.某班在学习“过氧化钠的性质”时,该班同学进行了以下两个实验:
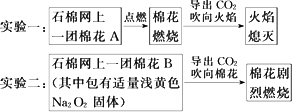
(1)提出问题实验一的CO2能灭火,实验二的CO2为何能“点火”?
(2)假设与猜想
①Na2O2与CO2发生了反应,可能有Na2CO3生成;
②棉花燃烧,说明该反应放热,使温度达到了棉花的着火点;
③剧烈燃烧,反应中可能有________生成.
(3)设计并进行实验,观察、解释和结论
请你帮助他们完成下表:
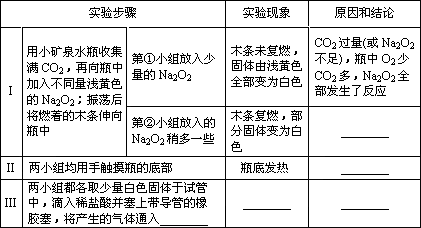
(4)类比推理
Na2O2与H2O反应后应该有NaOH和O2生成.则向包有Na2O2的棉花上滴两滴水,棉花也应剧烈燃烧;向生成的溶液中滴入酚酞应该变红色.
(5)实验与解释
①向小烧杯(底部垫砂)中包有Na2O2的脱脂棉上滴两滴水,发现有气泡产生,杯底发热,但棉花没有燃烧,其原因可能是________;
②向杯中的溶液滴入酚酞,溶液变红色,振荡后红色消失,其原因可能是________.
(6)联想与启示根据上述实验及分析,请为Na2O2的说明书写保存注意事项:________.
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3 滴 KSCN KSCN 溶液 |
无红色出现 无红色出现 |
说法A不正确 |
| 序号 | 实验步骤 | 现象 | 结论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 苹果中含有酚类物质 |
| ② | 一块放置于空气中 另一块迅速浸入0.1mol?L-1NaCl溶液中 |
表面逐渐褐变 相当长一段时间内,无明显变化 |
苹果褐变与 氧气 氧气 有关 |
| ③ | 另两块分别立刻放入90℃~95℃的开水和0.1mol?L-1盐酸中浸泡2min后取出,放置于空气中 | 相当长一段时间内,均无明显变化 | 苹果褐变与 多酚、氧化酶的活性 多酚、氧化酶的活性 有关 |
| ④ | 最后两块分别立刻放入各0.1mol?L-1的NaHCO3溶液和Na2SO3溶液里浸泡2min后取出,放置于空气 | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化 | 亚硫酸钠溶液能阻止苹果褐变 |


| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
溶液为红色 溶液为红色 |
固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含 固体物质中不含 FeCl2 固体物质中不含 FeCl2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com