
题目列表(包括答案和解析)
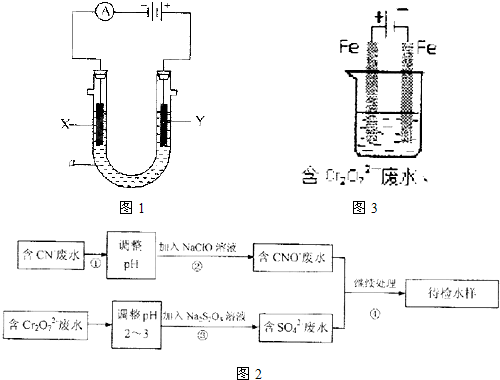
(1)写出电解饱和氯化钠溶液时的电极反应式和总的离子反应方程式。?
阳极: ,阴极: ;?
总反应方程式: 。?
(2)离子交换膜电解槽一般采用金属钛作阳极,其原因是 ,阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是 。
(3)为使电解氯化钠的速率加快,下列措施可行的是 。
a.增大阴极碳钢网面积 b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离 d.提高电解时的电源电压?
(4)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO2-4等杂质离子,使用的试剂有:?a.Na2CO3?溶液; b.Ba(OH)2溶液; c.稀盐酸。其合理的加入顺序为 (填试剂序号)。
(5)如果在容积为10 L的离子交换膜电解槽中,1 min在阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变) 。?
(6)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需用Cl2和ClO2的物质的量之比为 。?

氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为???????????????????????????????????? 。
(2)下列实验能比较镁和铝的金属性强弱的是???? ??? ?? (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s)??? ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s)???? ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是?????????????????????? ????? 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为??????????????????? ????????? ???????????? 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g)  Si3N4(s) + 12HCl(g)?? △H<0??
Si3N4(s) + 12HCl(g)?? △H<0??
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是???????? mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应????? (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=?????????????? 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为????? 以上。
(5分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的基态电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图示。该合金的化学式为_______________;

(4)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。该结构中,氮原子的杂化轨道类型为_______________。氧原子的杂化轨道类型为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com