
题目列表(包括答案和解析)
为测定某镁铝合金的成分,取14.7g合金完全溶于500mL3mol·L-1的硫酸中,现加入400mL 8mol·L-1的NaOH溶液充分反应,得到白色沉淀。
1)、 若只有一种沉淀,试确定合金中镁的质量分数范围。
2)、若沉淀质量为26.3g,则镁的质量分数为多少?
为测定某镁铝合金的成分,取14.7g合金完全溶于500mL3mol·L-1的硫酸中,现加入400mL 8mol·L-1的NaOH溶液充分反应,得到白色沉淀。
1)、 若只有一种沉淀,试确定合金中镁的质量分数范围。
2)、若沉淀质量为26.3g,则镁的质量分数为多少?
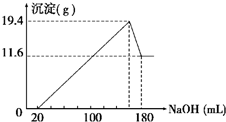 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:
有5.1g镁、铝合金,投入500mL 2 mol/L盐酸溶液后,金属全部溶解后,再加入4 mol/L NaOH溶液,若要达到沉淀最大值,则加入NaOH溶液的体积应为 ( )
A、250mL B、425mL C、500mL D、560mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com