
题目列表(包括答案和解析)
a、b、c、d、e为原子序数依次增大的五种短周期元素,下表列出了它们的一些重要参数:
|
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
| Cu2+/molL-1 | 0.1 | 0.01 | 0.001 | 0.0001 | 0.00001 |
| 溶液pH | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
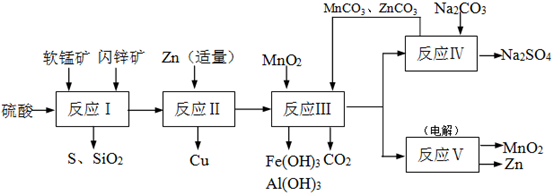
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:

(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式: ;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Zn(OH)2 |
|
开始沉淀pH |
2.3 |
4.0 |
5.6 |
|
完全沉淀pH |
4.1 |
5.2 |
8.0 |
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为 (写化学式),III中加入MnO2的作用是 ;
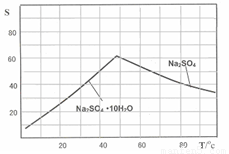
(3)Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水)如图,则IV中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 ;
(4)V是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为 ;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO2、ZnCO3、MnCO3、 和 (写化学式)。
以下物质;(1) 甲烷;(2) 苯;(3) 聚乙烯;(4) 苯乙烯(5) 2-丁炔;(6) 环己烷;(7) 邻二甲苯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是:
| A.(3) (4) (5) | B.(4) (5) (7)) | C.(4) (5) | D.(3) (4) (5) (7) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com