
题目列表(包括答案和解析)
在下列变化或工作过程中溶液的pH值一定要减小的是
[ ]
A.浓盐酸受热
B.![]() 在空气中变质
在空气中变质
C.用铂电极电解![]() 溶液
溶液
D.钢铁在中性或弱酸性条件下在空气中受到腐蚀
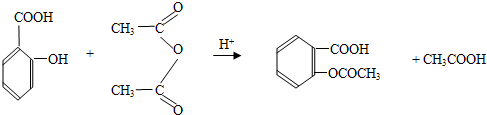
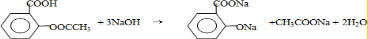

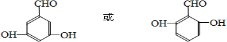
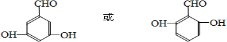
①在中性或弱酸性介质中先用过量的Br2,将试样中的I-氧化成![]() ;
;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将![]() 还原为I2;
还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2====2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量:
(1)写出步骤①②中发生反应的离子方程式:
①__________________________________________,
②__________________________________________。
(2)若样品中有1 mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00 mL,终点时耗用0.050 mol·L-1 Na2S2O3溶液20.06 mL,试计算样品溶液中KI的含量(g·L-1)。
少量的碘化物可用以下方法进行测定,其步骤如下:
①在中性或弱酸性介质中先用过量的Br2,将试样中的I-氧化成![]() ;
;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将![]() 还原为I2;
还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2====2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量:
(1)写出步骤①②中发生反应的离子方程式:
①__________________________________________,
②__________________________________________。
(2)若样品中有1 mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00 mL,终点时耗用0.050 mol·L-1 Na2S2O3溶液20.06 mL,试计算样品溶液中KI的含量(g·L-1)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com