
题目列表(包括答案和解析)
|
微观粒子是化学研究的主要对象.若阿伏加德罗常数为6.02×1023 mol-1,下列对粒子数判断正确的是 | |
| [ ] | |
A. |
常温常压下,2.24 LCO2气体中含有的分子数为0.1×6.02×1023 |
B. |
2.8 g |
C. |
0.3 L 1 mol/L Na2SO4溶液中含有的Na+数为0.3×6.02×1023 |
D. |
1.7 g NH3中含有的质子数为0.4×6.02×1023 |
微观粒子是化学研究的主要对象。若阿伏加德罗常数为6.02×1023mol—1,下列对粒子数判断正确的是 ( )
A.常温常压下,2.24L CO2气体中含有的分子数为0.1×6.02×1023
B.2.8g [CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023
C.0.3L 1mol/L Na2SO4 溶液中含有的Na+数为0.3×6.02×1023
D.1.7gNH3中含有的质子数为0.4×6.02×1023
| A.分子数 | B.原子数 | C.质子数 | D.电子数 |
纳米材料的表面粒子占总粒子的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状与氯化钠晶胞的大小和形状相同,则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
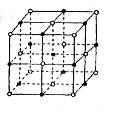
A.7:8 B.13:14 C.25:26 D.26:27
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com