
题目列表(包括答案和解析)


(1)在上面元素周期表中全部是金属元素的区域为___________。
a.A b.B c.C d.D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是___________。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜;乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是___________ (填名称),可以验证该结论的实验是______________________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(10分)过渡金属元素氧化物应用研究是目前科学研究的前沿之一,回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、及水说法正确的是_____________。
A.苯分子中含有碳碳键的键能较大,不易发生化学反应
B.苯不能使酸性KMnO4溶液褪色,说明其分子中不含碳碳双键
C.甲醛的沸点比甲酸低,主要原因是甲酸分子间可以形成氢键
D.水分子稳定性高,是因为水分子间能形成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是+2价的Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑵ 用A、B、O表示这类特殊晶体的化学式__________。(A、B为元素代号,O为氧元素)
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:____________。(用含x的代数式表示)
 ⑶26Fe3+的核外电子排布式为: 。
⑶26Fe3+的核外电子排布式为: 。
⑷下列有关说法正确的是__________________。
A.镧、锰、氧分别位于周期表f、d、p区
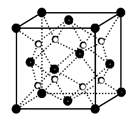
B.晶体铬属于体心立方堆积,其堆积方式如右图:
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
(10分)过渡金属元素氧化物应用研究是目前科学研究的前沿之一,回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、及水说法正确的是_____________。
A.苯分子中含有碳碳键的键能较大,不易发生化学反应
B.苯不能使酸性KMnO4溶液褪色,说明其分子中不含碳碳双键
C.甲醛的沸点比甲酸低,主要原因是甲酸分子间可以形成氢键
D.水分子稳定性高,是因为水分子间能形成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是+2价的Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。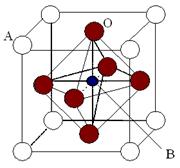
用A、B、O表示这类特殊晶体的化学式__________。(A、B为元素代号,O为氧元素)
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:____________。(用含x的代数式表示)
⑶26Fe3+的核外电子排布式为: 。
⑷下列有关说法正确的是__________________。
A.镧、锰、氧分别位于周期表f、d、p区
B.晶体铬属于体心立方堆积,其堆积方式如右图:
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com