
题目列表(包括答案和解析)
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |

氧化还原是常见的反应类型,根据信息回答以下问题:
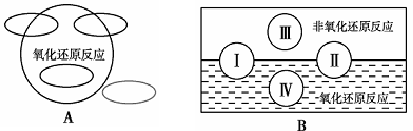
1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。③写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,
其中水作为 剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO—光→ 2HCl + O2↑ 氧化产物 被还原的元素
(2)2NaCl+ 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、 有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ,还原性最强的是 ,用离子方程式表示氧化性强弱的事实:
。
氧化还原是常见的反应类型,根据信息回答以下问题:
1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。③写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,
其中水作为 剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO —光→ 2HCl + O2↑ 氧化产物 被还原的元素
(2)2NaCl + 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ,还原性最强的是 ,用离子方程式表示氧化性强弱的事实:
。
氧化还原是常见的反应类型,根据信息回答以下问题:

1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。③写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,
其中水作为 剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO —光→ 2HCl + O2↑ 氧化产物 被还原的元素
(2)2NaCl + 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、 有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ,还原性最强的是 ,用离子方程式表示氧化性强弱的事实:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com