
题目列表(包括答案和解析)
市场上一种新型洗涤剂的主要化学成分是两种常见物质固体A和液体B形成的白色结晶化合物,某化学小组对该洗涤进行探究,实验过程如下:
(1)提出问题:该洗涤剂中A和B各是什么?它们的配比如何?
(2)定性实验探究:
| 序号 | 主要操作步骤 | 主要实验现象 | 结论 |
| ① | 取少量洗涤剂,加水溶解,用洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧 | 火焰呈黄色 | 洗涤剂中含Na+ |
| ② | 取溶液1-2mL于试管中,滴入酚酞溶液,振荡,然后加入MnO2粉末少许,并将带火星的木条伸入试管内 | 溶液先变红,后逐渐褪色;气泡冒出剧烈,木条复燃 | A为______ B为_______ |
| ③ | 取②上层清液少许,加入足量稀硫酸,将燃着的木条伸入试管内;另取②上层清液少许,滴入稀MgCl2溶液 | 有无色无味气体放出,木条火焰熄灭,有白色沉淀生成 |
(3)定量实验探究:为测定洗涤剂中A和B的配比,请从下图中选择适当的仪器,组装一套测定某物理量的最简便的装置,该装置的连接顺序从左至右是(填各接口的字母代号)____________,测定的物理量是____________,欲达实验目的还必须知道的物理量是____________。(4)根据该结晶化合物的性质,你认为在储存和使用该洗涤剂时应注意的问是 (写出任意一点即可)。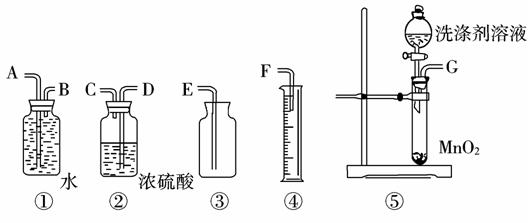
甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答:
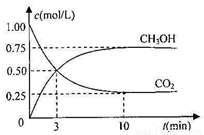
①从反应开始到平衡,氢气的反应速率:v(H2)= 。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是 。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1= (计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2 (填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为 极,充入O2的电极反应式 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H= 。(用含△H1、△H2的式子表示)
甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答: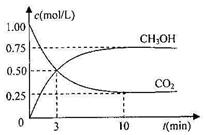
①从反应开始到平衡,氢气的反应速率:v(H2)= 。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是 。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1= (计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2 (填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为 极,充入O2的电极反应式 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H= 。(用含△H1、△H2的式子表示)

实验现象记录如下:
①黑色氧化铜粉末变为光亮的红色;
②生成物A能使无水硫酸铜粉末变蓝色;
③镁带能在另一生成物B中燃烧生成一种固态物质C,C与A反应生成碱性物质D和一种能使湿润的红色石蕊试纸变蓝色的气体E。
试回答以下问题:
(1)虚线方框内应选的干燥装置是_______(填标号)。
序号 | 干燥装置 |
1 |
|
2 |
|
(2)A的化学式是___________ ,B的化学式是___________ 。
(3)在制氨装置中,固体NaOH的作用是____________________________。
(4)写出下列反应的化学方程式。
a.氨与灼热的氧化铜反应______________________;
b.C与A反应_____________。
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com