
题目列表(包括答案和解析)
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是( )
A.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
B.根据变化过程中是否有化学键的断裂,将物质变化分为物理变化和化学变化
C.根据元素的化合价是否变化,将化学反应分为氧化还原反应和非氧化还原反应
D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
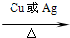 2CH3CHO+2H2O
2CH3CHO+2H2O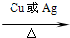 2CH3CHO+2H2O
2CH3CHO+2H2O| 水浴加热 |
| 水浴加热 |
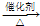
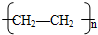 ,
,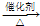
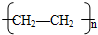 ,
,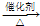 CH3CH2Cl,
CH3CH2Cl,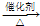 CH3CH2Cl,
CH3CH2Cl, CH3COOC2H5+H2O,
CH3COOC2H5+H2O, CH3COOC2H5+H2O,
CH3COOC2H5+H2O,(9分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等类型的化合物。
⑴写出氯离子的离子结构示意图 ▲ 。
⑵写出卤素互化物溴碘原子比1∶1的共价化合物(IBr)的电子式 ▲ ,其中溴元素的化合价为 ▲ 。
⑶氟化氢气体的沸点较高,这是因为氟化氢分子之间存在 ▲ 。
⑷①HClO4、②HClO、③H2SO4的酸性由强到弱的顺序为 ▲ (填序号)。
⑸用新制的氯水、NaBr溶液、四氯化碳作为试剂,验证氯气的活泼性强于溴单质。简述实验操作过程和实验现象 ▲ 。
(12分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为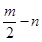 。请回答下列问题:
。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为 。 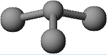
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
(5)写出B与D在高温下完全反应后生成物的电子式___ __ ,结构式___
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com