
题目列表(包括答案和解析)
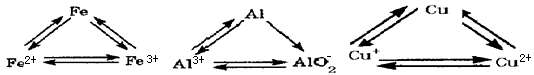
(4分)钠、铁两种金属单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属中,最高价氧化物的水化物属于强碱的是____,由此说明,钠的金属性比铁____(填“强”或“弱”)。
(2)某些补铁剂的成分是硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是____(填序号)。
① 稀盐酸 ② 石蕊溶液 ③ KSCN溶液
(3)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为
(4分)铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
_ ___、__ __(填化学式)。
(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3 胶体。当光束通过下列物质时,能观察到丁
达尔效应的是__ __(填序号)。
①氯化铁溶液 ② Fe(OH)3 胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方
程式为 。



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com