
题目列表(包括答案和解析)
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。
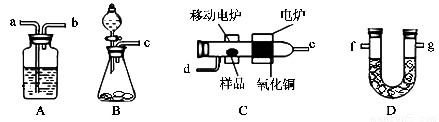
请回答下列问题:
(1)请按气体流向连接实验装置B→?????? ? →C→A→D→???????? (用装置编号填写)。
(2)B装置中制O2时所用的药品是???????????????????????????????????????????? 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是???????????????????????????????????? ;停止加热后,也要再通一段时间的氧气,目的是?????????????????????????????????? .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式?????????????????????????? 。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式?????????????????????????????????????? 。
② 除去Z中混有的Y所需的试剂和主要仪器是????????????? 、????????????? 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式????????????????????????????????????????? 。
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A装置可以重复使用。
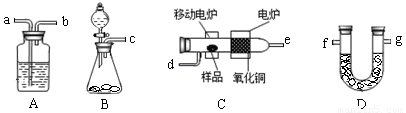
请回答下列问题:
(1)请按气体流向连接实验装置? →? →? →d→? →? →? → g(用仪器接口编号填写)。
(2)B装置中制O2时所用的药品是??????? 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是?????? ;停止加热后,也要再通一段时间的氧气,目的是???????? 。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式??????? 。
 (4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
实验一:X在一定条件下可催化氧化最终生成有机物Y.
实验二:X与Y在浓硫酸加热条件下生成有机物Z.
则①写出实验二中反应的化学方程式??????????????????????????????????? 。
②除去Z中混有的Y所需的试剂和主要仪器是???????? 、??????????? 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式???????????????????????? 。
 (1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com