
题目列表(包括答案和解析)
| A.相同物质的量的A、B单质分别与足量的盐酸反应,A产生的氢气比B多 |
| B.在常温下,A可以与水反应产生氢气,B不能与水反应产生氢气 |
| C.A的阳离子的氧化性比B的阳离子的氧化性弱 |
| D.A、B做电极材料,与某电解质溶液形成原电池时,A为负极,B为正极 |
用实验确定某酸HA是弱电解质,甲、乙两同学的方案分别是
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测定出该溶液的pH,即可证明HA是弱电解质
乙:①用已知物质的量的浓度的HA溶液.盐酸分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质
(1)两个方案的第①步中都用到的定量仪器是________.
(2)甲方案中,说明HA是弱电解质的理由是该溶液的pH________1(填“>”“<”或“=”);乙方案中说明HA是弱电解质的现象是________.
a.装HCl溶液的试管中放出气体的速率快
b.装HA溶液的试管中放出气体的速率快
c.两个试管中放出气体的速率一样快
(3)请你指出乙方案中难以实现之处和不妥之处________.
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并做简明扼要的表述_________________.
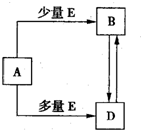 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com