
题目列表(包括答案和解析)
①因为增大压强,反应速率加快,平衡正向移动,所以在生产中压强越大越好
②降低温度,平衡正向移动,但是反应速率减慢,所以温度要选500℃
③使用铁触媒可以大大加快反应速率
④将氨变成液体,及时从平衡混合气中分离出去,可以使平衡正向移动
⑤氮气、氢气要循环使用,增加氮气的量,可以提高氢气的转化率,但氮气的转化率会降低
⑥可以选用的催化剂很多,且催化剂可以提高平衡转化率
A.③④⑤ B.①③⑤ C.②④⑥ D.③④⑥
(1)以下反应(或过程):①硝酸铵晶体溶于水 ②燃烧天然气 ③生石灰与水反应
④稀盐酸与氢氧化钠溶液反应 ⑤Ba(OH)2·8H2O与氯化铵晶体反应 ⑥锌粒和稀硫酸混合,
其中属于放热反应(或过程)的是 (填序号),写出吸热反应的化学方程式
 。
。
(2)以反应2Fe3+ + Cu=2Fe2++ Cu2+为原理设计一个原电池,
在方框中画出原电池的示意图(在图上标出两极材料、
正负极、电解质溶液和电子流向)。
(3)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,
能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4 (s)+12HCl(g),一定条件下,在密闭恒容的容器中,表示
Si3N4 (s)+12HCl(g),一定条件下,在密闭恒容的容器中,表示
上述反应达到化学平衡状态的是 。
①3υ逆(N2)=υ正(H2) ②υ逆(HCl)=4υ正(SiCl4) ③混合气体的密度保持不变
④c(N2): c(H2): c(HCl)=1:3:6
 ①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 ,原因是该反应是 。
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 ,原因是该反应是 。
②哪一时段的反应速率最小 ,原因是 。
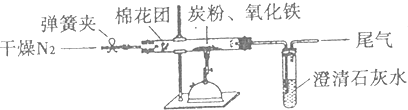
(15分)Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。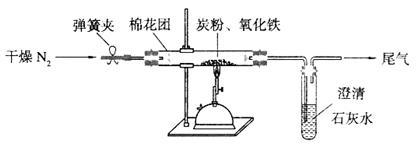
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②下列装置可用于实验室制取氮气的是 。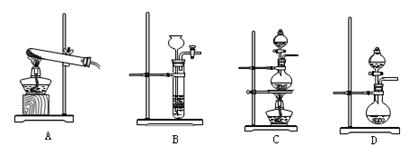
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g) CH3CH2OH (g)+H2O (g)
CH3CH2OH (g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | CO转化率(%) |
| 1 | 150 | 1/3 | 0.1 | K^S*5U.C# |
| 2 | x | 1/3 | 5 | |
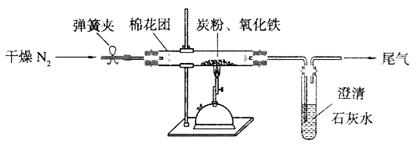
Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 ![]()
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
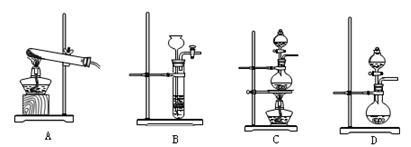
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②下列装置可用于实验室制取氮气的是 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g ,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g)![]() CH3CH2OH (g)+H2O (g)
CH3CH2OH (g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | CO转化率(%) |
| 1 | 150 | 1/3 | 0.1 |
|
| 2 | x | 1/3 | 5 |
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com