
题目列表(包括答案和解析)
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的![]() 键数目为 。
键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。

(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是 ;甲醛分子中碳原子的轨道杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
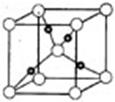
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
(22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的 键数目为 。
键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。
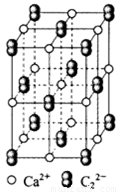
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是 ;甲醛分子中碳原子的轨道杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
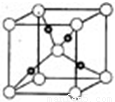
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
(22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的![]() 键数目为 。
键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是 ;甲醛分子中碳原子的轨道杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
(22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的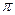 键数目为 。
键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是 ;甲醛分子中碳原子的轨道杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
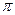 键数目为 。
键数目为 。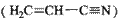 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。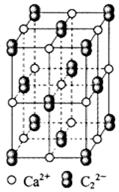
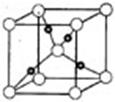
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com