
题目列表(包括答案和解析)
(11分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ·mol-1
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
②已知:N2、O2分子中化学键的键能分别是946 kJ·mol—1、497 kJ·mol—1,则NO分子中化学键的键能为 kJ·mol—1。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前3s内的平均反应速率v (N2) =_________________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③该可逆反应△S 0(填“>”、“<”或“=”),在_______________(填“高温”、“低温”或“任何温度”)下能自发进行。
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
A.负极的电极反应式为:
CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)= (用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的![]() ,下列有关该体系的说法正确的是 (填序号)
,下列有关该体系的说法正确的是 (填序号)
a 氢气的浓度减少 b 正反应速率加快,逆反应速率变慢,平衡正向移动
c 甲醇的物质的量增加 d 重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应 (填序号:A. 高温时 B.低温时 C.任何温度都能 D.任何温度都不能)自发进行。
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:
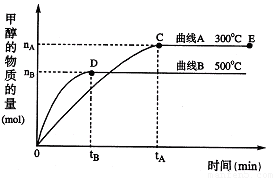
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)= (用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的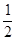 ,下列有关该体系的说法正确的是
(填序号)
,下列有关该体系的说法正确的是
(填序号)
a 氢气的浓度减少 b 正反应速率加快,逆反应速率变慢,平衡正向移动
c 甲醇的物质的量增加 d 重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应 (填序号:A. 高温时 B.低温时 C.任何温度都能 D.任何温度都不能)自发进行。
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)

(1)Q___________0(填“>”或“<”)。
(2)t1至t2时间内,用D的物质的量浓度表示的化学反应速率v(D)=____________。
(3)在上图中作出t1至t2时间内的c(D)变化的曲线。
(4)t2时压强p2_________p0(填“>”“<”或“=”),原因是_________。
(5)对ΔH的判断正确的是_________。
A.变为2Q B.介于Q与2Q之间
C.减小 D.不变

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com