
题目列表(包括答案和解析)
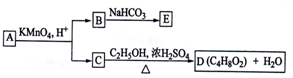
| A、B的结构简式为HOOC-CH2-COOH | B、C与乙醇发生了酯化反应 | C、A可以与氢氧化钠溶液发生中和反应 | D、E的分子式为C3H2O4Na2 |
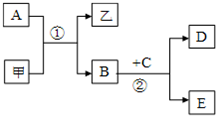 图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
| ||
| ||
| ||
| ||
| 烯经被氧化的部位 | CH2= | RCH= |
 |
| 氧化产物 | CO2 |  |
 |









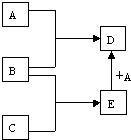 已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答: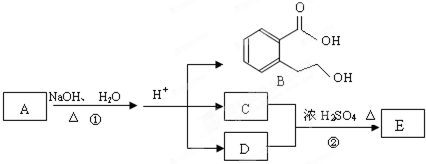
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


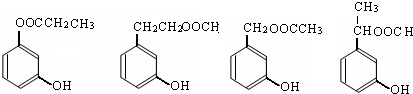 任意1种
任意1种 任意1种
任意1种湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com