
题目列表(包括答案和解析)
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。

(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗
C.第一次滴定用的锥形瓶用白醋润洗
D.该NaOH标准液保存时间过长,有部分变质,浓度降低
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗
C.第一次滴定用的锥形瓶用白醋润洗
D.该NaOH标准液保存时间过长,有部分变质,浓度降低
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。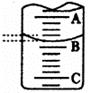
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
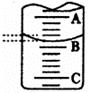
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.32 |
25.34 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗
C.第一次滴定用的锥形瓶用白醋润洗
D.该NaOH标准液保存时间过长,有部分变质,浓度降低
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com