(2011?龙岩模拟)某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
方案一:根据试样与足量70%硫酸反应产生的SO
2气体体积来测定.
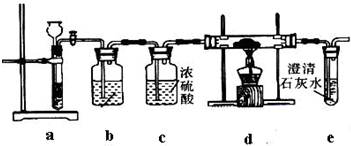
(1)请从图中选用适当的装置,装置的连接顺序是(填接口字母)
aedh
aedh
.
(2)按图连接好仪器,进行气密性检查的操作是
关闭分液漏斗活塞,将右侧导管放入水中,用手捂热锥形瓶,若导管口处有气泡冒出,松手后,导气管内上升一段稳定的水柱,则证明气密性完好
关闭分液漏斗活塞,将右侧导管放入水中,用手捂热锥形瓶,若导管口处有气泡冒出,松手后,导气管内上升一段稳定的水柱,则证明气密性完好
.
(3)甲装置中发生反应的化学方程式为
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
.
(4)称取2.0g试样,测得气体体积112mL(标况),则Na
2SO
3的质量分数为
31.5%
31.5%
.
方案二:根据试样与钡盐溶液反应产生硫酸钡沉淀的质量来测定.流程如下:

(5)操作2名称是
洗涤
洗涤
,其操作方法是
用玻璃棒引流,往漏斗中的沉淀上加入蒸馏水至浸没沉淀,待液体流净,重复操作2-3次
用玻璃棒引流,往漏斗中的沉淀上加入蒸馏水至浸没沉淀,待液体流净,重复操作2-3次
.若缺少该操作,测得的Na
2SO
3质量分数
偏小
偏小
(填偏大、偏小或不变).
(6)甲、乙两同学开展实验时,分别按下表叙述开展“操作1”(其余操作相同且符合实验规范要求),并得到表中所示的沉淀质量和亚硫酸钠质量分数(Na
2SO
3%)的计算表达式:
|
|
操作1 |
沉淀质量 |
Na2SO3%计算表达式 |
|
甲 |
先往溶液中加入足量盐酸,再滴入足量BaCl2溶液 |
b克 |
(1-)×100% |
|
乙 |
先往溶液中加入足量Ba(NO3)2 溶液,再滴入足量盐酸 |
c克 |
(1-)×100% |
乙
乙
(填“甲”或“乙”)的“Na
2SO
3%计算表达式”有问题,因为
先加足量的硝酸钡溶液,再滴入足量盐酸,产生的亚硫酸钡沉淀液会被硝酸氧化为硫酸钡沉淀
先加足量的硝酸钡溶液,再滴入足量盐酸,产生的亚硫酸钡沉淀液会被硝酸氧化为硫酸钡沉淀
.

 (2011?龙岩模拟)某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
(2011?龙岩模拟)某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.