
题目列表(包括答案和解析)
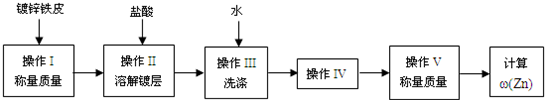
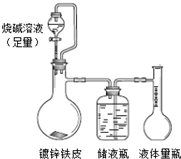
| 65×(V2+V3)×10-3 |
| 22.4×m |
| 65×(V2+V3)×10-3 |
| 22.4×m |
(10分) A、B、C、D、E是位于短周期的主族元素。已知:① 热稳定性:H m D > H m C;② C m-、E (m-1)- 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) HmDm的电子式_____________。
(2) 还原性强弱:C m- ___ E (m-1)- (填“>”或“<”);能证明其还原性强弱的离子方程式为:_____ ___。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:____________________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。在该溶液中溶质中含有的化学键类型是 。
(5) 在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。

已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
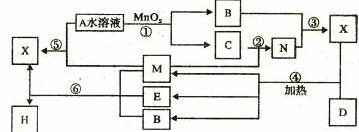
A的结构式 ,E的化学式为 ;
在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填序号)
写出下列反应的化学方程式② ④
将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
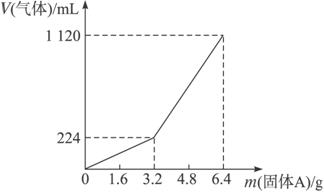
已知加入固体A的质量m≤3.2 g时,收集到的气体为氢气;当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
试分析计算:
(1)3.2 g固体A中所含的物质有_____________。
(2)3.2 g固体A中各物质的物质的量分别为_______________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)______________。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到气体体积(标准体积)V=____________mL(用含m的代数式表示)。
(10分)前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物。M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄。
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 。
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、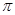 键之比是 。
键之比是 。
(3)上述五种元素能形成的晶体类型有 (填编号)。
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298 K时固体M在氧气中燃烧生成1 mol M203固体时,放出热量1676.2 kJ;固
体N在氧气中燃烧生成1 mol N304固体时,放出热量1118.4 kJ。请写出298 K时,由M
单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是____ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com