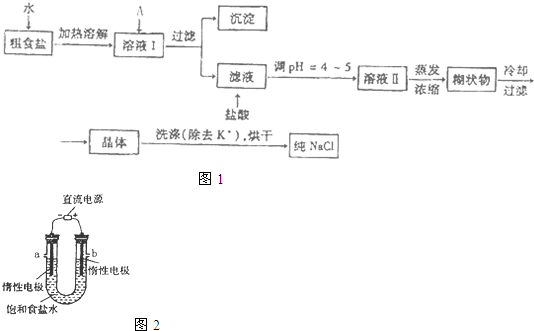
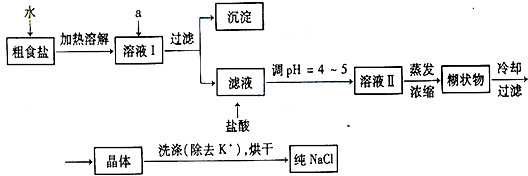
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量
Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
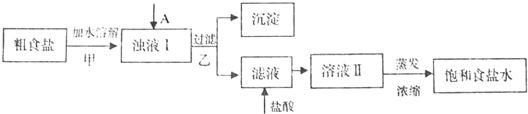
提供的试剂:饱和Na
2CO
3溶液、饱和K
2CO
3溶液、NaOH溶液、BaCl
2溶液、Ba(NO
3)
2溶液
(1)①欲除去浊液I中的
Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为
NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH
NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH
(只填化学式),检验溶液中
SO42-沉淀完全的操作为
稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全
稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全
.
②加盐酸的目的是(用离子方程式表示)
H++OH-═H2O,CO32-+2H+═H2O+CO2↑
H++OH-═H2O,CO32-+2H+═H2O+CO2↑
.
③如果在实验室中完成下列过程,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是:
甲
搅拌
搅拌
,乙
引流
引流
.
(2)工业上用惰性电极电解饱和食盐水制取盐酸,写出电解饱和食盐水的化学方程式
;用试纸检验电解食盐水阳极产物的方法是
用湿润的KI淀粉试纸放在阳极区气体中,试纸变蓝色,证明有氯气生成;
用湿润的KI淀粉试纸放在阳极区气体中,试纸变蓝色,证明有氯气生成;
.