
题目列表(包括答案和解析)
 (2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.
(2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.

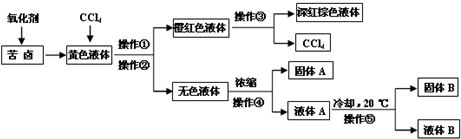
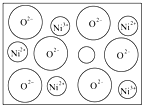 天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比.
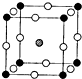
天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比. (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com