
题目列表(包括答案和解析)
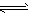 C(g)+2D(g),经过一段时间后反应达到平衡,经5 min测定C的平均反应速率为0.1 mol·L-1·min-1。则下列叙述中正确的是
C(g)+2D(g),经过一段时间后反应达到平衡,经5 min测定C的平均反应速率为0.1 mol·L-1·min-1。则下列叙述中正确的是 在2L密闭容器内充入5 mol A和2.5 mol B使之发生反应:3A(g)+B(g) ![]() C(g)+2D(g),经过5min反应达到平衡,经测定C的平均反应速率为0.1mol/(L?min)。下列叙述中正确的是 ( )
C(g)+2D(g),经过5min反应达到平衡,经测定C的平均反应速率为0.1mol/(L?min)。下列叙述中正确的是 ( )
A.恢复至原温度,容器内压强增大 B.A的平均反应速率为0.1mol/(L?min)
C.达到平衡时,B比A的转化率小 D.B的平衡浓度为0.25mol/L
合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1 mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2+3H2 2NH3 。
Ⅰ:若维持温度不变,且密闭容器的容积固定为1 L。
(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。
(2)如果开始时,向该容器内加入0.5 moL N2 ,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mol和NH3 _______mol。
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、bmol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示) 。
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。
(4)开始时加入1mol N2和2mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号)
(甲)大于0.2 mol (乙)等于0.2 mol
(丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是__________________________________________。
合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1 mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2+3H2  2NH3。
2NH3。
Ⅰ:若维持温度不变,且密闭容器的容积固定为1 L。
L。
(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。
(2)如果开始时,向该容器内加入0.5 moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mo l和NH3 _______mol。
l和NH3 _______mol。
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示) 。
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。
(4)开始时加入1 mol N2和2 mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号)
(甲)大于0.2 mol (乙)等于0.2 mol
(丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是__________________________________________。
合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1 mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2+3H2 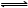 2NH3 。
2NH3 。
Ⅰ:若维持温度不变,且密闭容器的容积固定为1 L。
(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。
(2)如果开始时,向该容器内加入0.5 moL N2 ,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mol和NH3 _______mol。
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示) 。
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。
(4)开始时加入1 mol N2和2 mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号)
(甲)大于0.2 mol (乙)等于0.2 mol
(丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com