
题目列表(包括答案和解析)
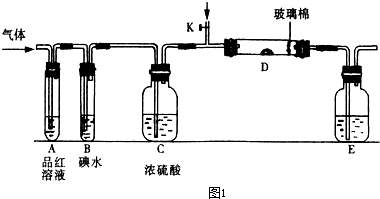
| ||
| △ |
| ||
| △ |

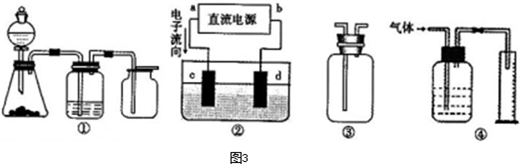
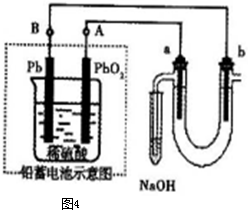
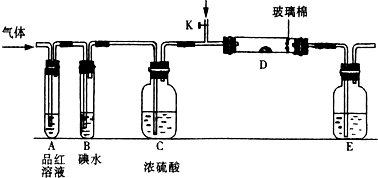
| ||
| △ |
| ||
| △ |
| 实验 序号 |
实验 温度/℃ |
0.1mol/LNa2S2O3溶液的体积/mL | H2O的 体积/mL |
0.1mol/LH2SO4溶液的体积/mL | 所需 时间/s |
| 甲 | 25 | 5 | 5 | 2 | / |
| 乙 | 25 | 5 | 6 | 1 | / |
| 丙 | 35 | 5 | 5 | V | / |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解. | |
| 步骤2: 向试管中加入过量1 mol?L-1HCl溶液.充分振荡,静置. 向试管中加入过量1 mol?L-1HCl溶液.充分振荡,静置. |
有淡黄色沉淀生成. 有淡黄色沉淀生成. |
| 步骤3: 取上层清液于另一试管中,滴加少量0.1 mol?L-1BaCl2溶液. 取上层清液于另一试管中,滴加少量0.1 mol?L-1BaCl2溶液. |
有白色沉淀生成,证明固体中混有Na2SO4. 有白色沉淀生成,证明固体中混有Na2SO4. |
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com