
题目列表(包括答案和解析)
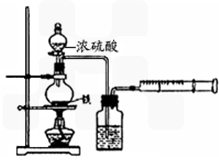
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:

(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是________.
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式________.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
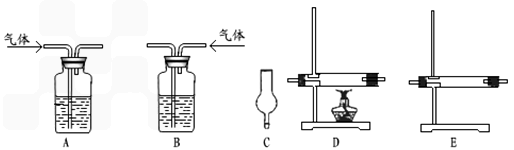
仪器如下图(可重复使用,可根据需要取用);
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是________.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有________.
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为________;如果该过程中共消耗了11.2 g铁,反应后的溶液能吸收标准状况下1.12 L氯气,则原溶液中含有Fe3+的物质的量为________mol.
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是________.
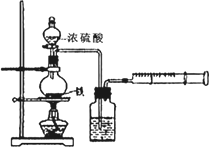
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式________.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
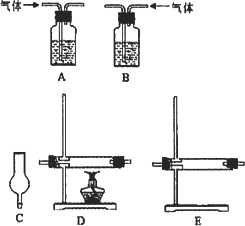
仪器如下图(可重复使用,可根据需要取用);
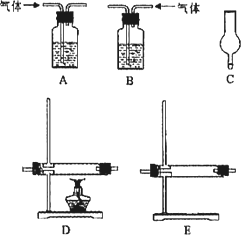
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是________.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有________.
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为________;如果该过程中共消耗了11.2 g铁,反应后的溶液能吸收标准状况下1.12 L氯气,则原溶液中含有Fe3+的物质的量为________mol.
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
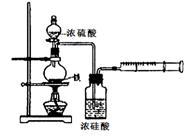
①洗气瓶中浓硫酸的作用是 。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式 。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);
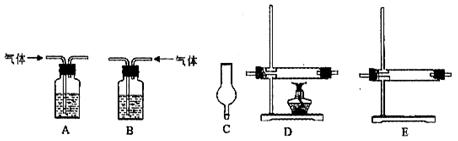
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)

②若混合气体中含有氧气,实验过程中能观察到的现象是 。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有 。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为 ;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为 mol。
(16分)为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。

①洗气瓶中浓硫酸的作用是 。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式 。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氧气,实验过程中能观察到的现象是 。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有 。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为 ;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com