
题目列表(包括答案和解析)
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有????????????????????? 。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
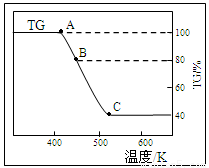
①试确定B点对应固体物质的化学式??????????????? ;
②写出B C对应的化学方程式????????????? 。
C对应的化学方程式????????????? 。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用???????????? 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为??????????????????????????????????????????????????????????? 。
(3)在步骤②中,下列操作会引起测定结果偏高的是????????????? 。
A、滴定管在盛装高锰酸钾前未润洗
B、滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数
D、滴定前读数正确,滴定终点时仰视读数
(4)0.20g 样品中 FeC2O4 的质量分数为 ????????????? 。(不考虑步骤②中的损耗)
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有 。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。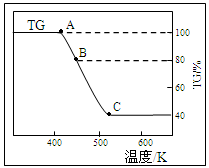
①试确定B点对应固体物质的化学式 ;
②写出B C对应的化学方程式 。
C对应的化学方程式 。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为 。
(3)在步骤②中,下列操作会引起测定结果偏高的是 。
| A.滴定管在盛装高锰酸钾前未润洗 |
| B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 |
| C.滴定前读数正确,滴定终点时俯视读数 |
| D.滴定前读数正确,滴定终点时仰视读数 |
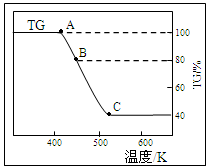
 C对应的化学方程式 。
C对应的化学方程式 。| A.滴定管在盛装高锰酸钾前未润洗 |
| B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 |
| C.滴定前读数正确,滴定终点时俯视读数 |
| D.滴定前读数正确,滴定终点时仰视读数 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com