
题目列表(包括答案和解析)
有关酸雨危害的记载:
SO2是主要的大气污染物之一,它对人体的直接危害是引起呼吸道疾病.它还是形成酸雨的罪魁祸首之一,酸雨可谓“空中死神”,已成为全球性的环境问题.
猖獗的酸雨严重地威胁着地球.据资料记载,仅在1980年一年内,美国和加拿大就有5万余人成了酸雨的猎物.比利时是西欧酸雨污染最为严重的国家,它的环境酸化程度已超过正常标准的16倍.在意大利北部,5%的森林死于酸雨.瑞典有15000个湖泊酸化.挪威有许多马哈鱼生活的河流已被酸雨污染.世界古迹、桥梁受酸雨腐蚀越来越快.号称世界最大露天博物馆——智利复活岛上的石雕人像,正面临着解体和倒塌的威胁,美国每年花在修理受损古迹方面的费用超过了50亿美元.闻名世界且代表我国古建筑精华的北京汉白玉石雕,近年来也遭到意想不到的损害,故宫太和殿台阶的栏杆上雕刻着各式各样的浮雕花纹,50多年前图案清晰可辨,如今却大多模糊不清,甚至成光板.我国江苏、安徽、湖北、福建、江西、浙江七省的大豆田曾经受酸雨影响造成经济损失一年达1380多万元.
阅读资料后,你有何感想?
(1)酸雨的危害大致有哪些方面?
(2)空气中SO2的主要来源?如何防止SO2污染环境?
SO2是引起大气污染的主要有害气体之一,我国大气质量标准中规定大气中SO2的最高浓度限值如下表:大气中SO2三级标准浓度限值
| 浓度限值[mg/(m3空气)] | |||
| 一级标准 | 二级标准 | 三级标准 | |
| 年日平均 | 0.02 | 0.06 | 0.10 |
| 日平均 | 0.05 | 0.15 | 0.25 |
| 任何一次 | 0.15 | 0.50 | 0.70 |
注:“年日平均”为任何一年的平均浓度均值不许超过的限值;“日平均”为任何一日的平均浓度不许超过的限值;“任何一次”为任何一次采样测定不许超过的浓度限值。
据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散,大气中SO2的含量高达3.8mg/(m3空气) ,烟尘达4.5mg/(m3空气),居民健康普遍受到危害,4天之内死亡人数约4000,流经该城市的主要河道也因此而受到污染,引起鱼类死亡。大气中的SO2将直接危害陆生高等植物的____组织,大气中SO2超标最容易影响人的_______系统而患疾病,而河流中鱼类死亡与SO2造成大气污染所形成______有关。
某空气污染监测仪是根据SO2和Br2水的定量反应来测定空气中的SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解池阳极的氧化反应,电解池的阳极室与阴极室是隔开的。当测量某地区空气中SO2的含量时,一天中作了三次取样监测,每次取样的空气(已除尘)都以1.5×10-4m3.min-1的流速进入电解池的阳极室,从电流计显示出每次的电流强度分别为8.56×10-6A、9.25×10-6A 、8.12×10-6A,每次都能够保持电解池中Br2浓度恒定并恰好与二氧化硫完全反应(设空气中不含与溴反应的其它杂质、1个电子电量为1.6×10-19C)。
写出此监测过程中发生反应的化学方程式。计算该地区空气中二氧化硫的含量有没有达到大气质量标准?
当大气中SO2污染较严重时,目前有一种降低其危害的方法是用直升飞机喷撒白垩粉,其化学方程式为___________________。
某火力发电厂所在地有较丰富的碳酸钙矿和菱镁矿,若该发电厂以含硫重油作燃料,请就地取材提出三种化学反应原理与上一小题不同的“脱硫”方法(用化学方程式表示,):
第一种______________;第二种______________; 第三种______________。
某10 6 kW火力发电厂以重油为燃料。以含硫3.5%的重油为燃料,重油使用量为0.18 dm3.kW-1.h-1(重油的密度为0.95g.cm3)。该厂开工率(每年实际运转天数)为80%,对烟道气的脱硫效率为90%。问一年间对烟道气脱硫回收的SO2能生成多少吨石膏(CaSO4·2H2O)?
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应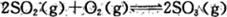 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=_________;用O2的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A. B.容器内压强保持不变.
B.容器内压强保持不变.
C. D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
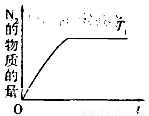
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染, 请写出CH4与NO反应的化学方程式:_________;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应)。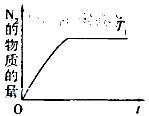
| | 浓度限值[mg/(m3空气)] | ||
| 一级标准 | 二级标准 | 三级标准 | |
| 年日平均 | 0.02 | 0.06 | 0.10 |
| 日平均 | 0.05 | 0.15 | 0.25 |
| 任何一次 | 0.15 | 0.50 | 0.70 |
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应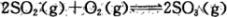 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=_________;用O2的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A.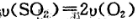 B.容器内压强保持不变.
B.容器内压强保持不变.
C.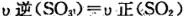 D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染, 请写出CH4与NO反应的化学方程式:_________;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com